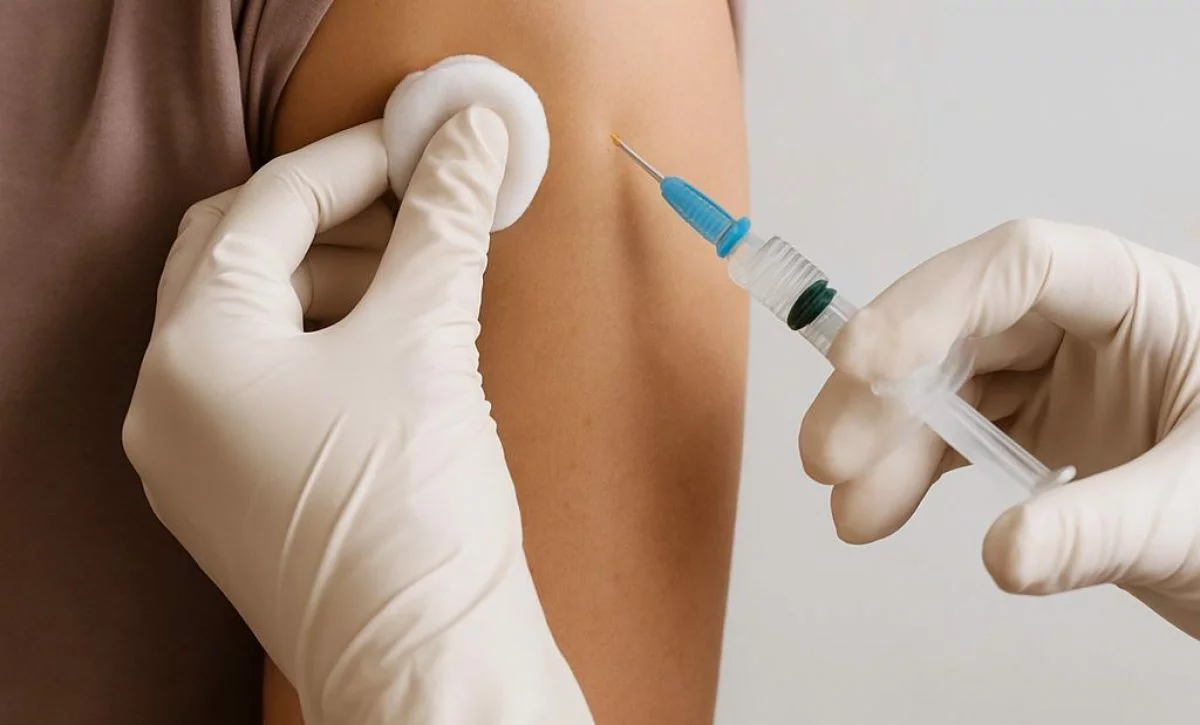
Vacuna Ixchiq suspendida por FDA por causar muertes y hospitalizaciones
- Redacción
- 26 agosto, 2025
- Importante
- chikungunya, FDA, Ixchiq, Portada, Vacuna, Valneva Austria GmbH
- 0 Comments
El Centro de Evaluación e Investigación de Productos Biológicos de la FDA suspendió la licencia de productos biológicos para la vacuna Ixchiq. Se trata de una vacuna de virus vivos atenuados de Valneva Austria GmbH. Esta se aprobó inicialmente por la FDA bajo la vía de aprobación acelerada en noviembre de 2023. Para la prevención de la enfermedad que causa el virus chikungunya en personas de 18 años o más con mayor riesgo de exposición.
La decisión del CBER se basó en serias preocupaciones de seguridad relacionadas con la vacuna. Esta parece estar causando una enfermedad similar a la chikungunya en los receptores de la vacuna. Así se registró una muerte por encefalitis directamente atribuible a la vacuna (la PCR en LCR fue positiva para la cepa vacunal del virus). Además se notificaron más de 20 eventos adversos graves compatibles con la enfermedad similar a la chikungunya. Los eventos adversos graves que se notificaron incluyeron 21 hospitalizaciones y 3 muertes.
Además, el beneficio clínico de la vacuna Ixchiq aún no se verificaron en estudios clínicos confirmatorios. El análisis beneficio-riesgo del CBER muestra, en general, que los beneficios de la vacuna no superan los riesgos, en la mayoría de los escenarios plausibles. Por estas razones, el CBER considera que esta vacuna no es segura y que su administración continuada al público representaría un riesgo para la salud.
El 9 de mayo de este año, la FDA y los Centros para el Control y la Prevención de Enfermedades (CDC) recomendaron conjuntamente una pausa en el uso de la vacuna Ixchiq. Esta pausa era para su aplicación en personas de 60 años y mayores. Mientras las agencias realizaban una investigación de los informes posteriores a la comercialización de eventos adversos graves. Incluyendo eventos neurológicos y cardíacos, en personas que recibieron la vacuna.
Asimismo, la FDA comunicó su intención de realizar una evaluación actualizada de la relación beneficio-riesgo para el uso de la vacuna Ixchiq en personas de 60 años o más. La FDA completó una evaluación actualizada de la relación beneficio-riesgo de Ixchiq, que incluye su uso en personas de 18 años o más. Con base en los datos disponibles y su evaluación de la relación beneficio-riesgo, la FDA eliminó la pausa y aprobó las actualizaciones de la información de prescripción. Además de la información para el paciente que exigió a la empresa Valneva Austria GmbH.
La aprobación de Ixchiq , el 9 de noviembre de 2023, incluyó una advertencia en la información de prescripción. Esta informaba que la vacuna podría causar reacciones adversas graves o prolongadas similares a las del chikunguña. Ixchiq contiene una versión viva y debilitada del virus del chikunguña y puede causar síntomas similares a los que experimentan las personas con chikunguña en quienes reciben la vacuna.
Tras la aprobación de Ixchiq, la FDA exigió a la empresa que realizara un estudio poscomercialización para evaluar el riesgo de reacciones adversas graves similares a las del chikunguña tras la administración de Ixchiq. El estudio estaba previsto que comenzara el 1 de octubre próximo.
“El monitoreo y la evaluación continuos de la seguridad de todas las vacunas siguen siendo una prioridad para la FDA. Las sospechas de eventos adversos pueden notificarse al Sistema de Notificación de Eventos Adversos de Vacunas (Vaers)”, indicó el organismo.








Leave A Comment