
Innovación farmacéutica 2025: menos aprobaciones, más “first‑in‑class” de impacto
- curecompass
- 13 febrero, 2026
- Gobierno, I+D, Medicina
- Abbvie, Bayer, Eli Lilly, FDA, GSK, Johnson & Johnson, Merck, Portada, Sanofi, Vertex
- 0 Comments
En 2025 la FDA aprobó 45 fármacos, menos que en años previos, pero con foco en especialización: Sanofi/Alnylam (Qfitlia), Vertex (Journavx) y GSK (Blujepa) lideran una ola de terapias “first‑in‑class” que prioriza impacto clínico sobre volumen de lanzamientos.
En 2025 la FDA aprobó 45 nuevos fármacos, por debajo de los 55 de 2023 y los 50 de 2024, pero con una innovación más concentrada: oncología y hematología sumaron 21 aprobaciones combinadas, mientras emergieron terapias siRNA para hemofilia, un analgésico no opioide de nueva clase para dolor agudo y el primer antibiótico oral “first‑in‑class” para infecciones urinarias en casi 30 años.
Lejos de una desaceleración, el año dejó un mensaje claro para la industria: el foco se desplaza del volumen a la capacidad de transformar estándares de cuidado en áreas críticas como cáncer, dolor, enfermedades raras y resistencia antimicrobiana.
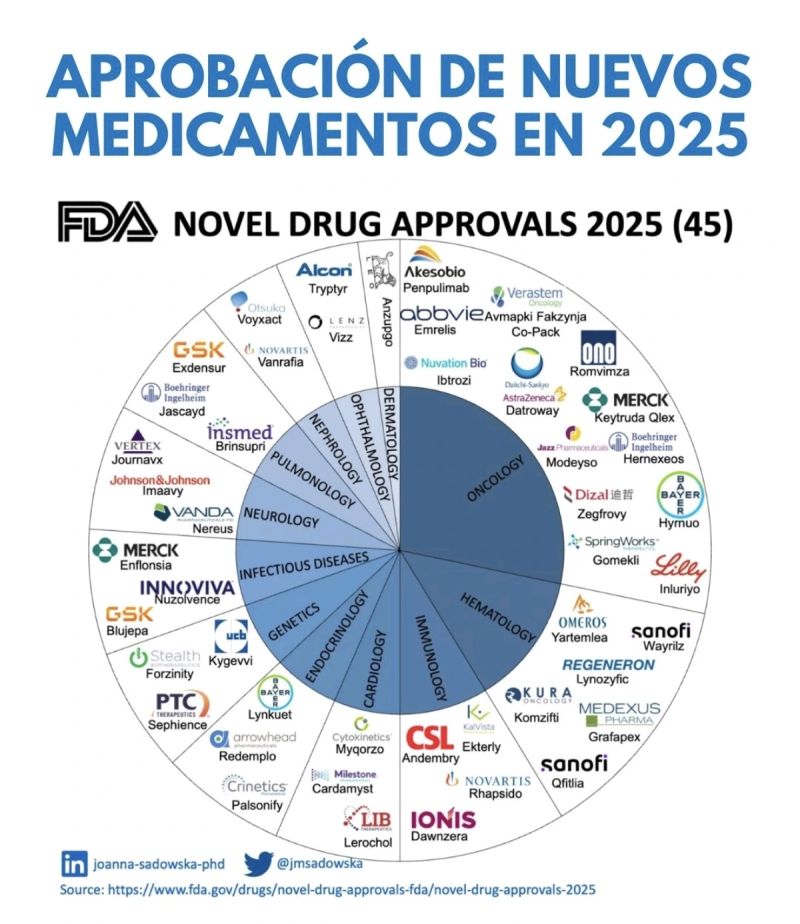
Menos volumen, más especialización: así se reconfiguran las aprobaciones de la FDA
El balance de 2025 muestra un descenso numérico de aprobaciones (45 nuevas moléculas frente a 50 y 55 en los dos años previos), pero con una mayor densidad clínica y tecnológica. Oncología y hematología lideran la tabla con 15 y 6 aprobaciones, consolidando la apuesta del sector por terapias dirigidas, inmuno‑oncología y tratamientos para neoplasias hematológicas complejas.
La diversidad modal también se profundizó: el pipeline incluyó conjugados anticuerpo‑fármaco (ADCs), terapias basadas en ARN, productos de cardiología de precisión y antiinfecciosos “first‑in‑class”, confirmando que la FDA sigue habilitando plataformas de frontera más allá de las pequeñas moléculas tradicionales. En ese contexto, la discusión en los laboratorios ya no gira en torno a “cuántos” productos llegan al mercado, sino a qué tan diferenciados son sus mecanismos y cuánto desplazan a los estándares de cuidado vigentes.
Qfitlia (Sanofi/Alnylam): la primera terapia siRNA para hemofilia A y B
Entre los hitos del año se destaca Qfitlia (fitusiran), desarrollada por Sanofi y Alnylam, que se convirtió en la primera terapia siRNA aprobada para hemofilia A o B, y en el primer y único tratamiento indicado para adultos y pacientes pediátricos desde los 12 años “con o sin inhibidores”. En la comunicación oficial, Alnylam subrayó que Qfitlia “se convierte en el sexto terapéutico de ARN de interferencia (RNAi) descubierto por la compañía aprobado por la FDA” y remarcó que “tiene el potencial de beneficiar a las aproximadamente un millón de personas con hemofilia A y B en el mundo”.
La aprobación consolida el modelo de medicina de precisión basada en silenciamiento génico, al actuar aguas arriba sobre el mRNA y reducir de manera sostenida la producción de antitrombina para prevenir episodios de sangrado. Para Sanofi, Qfitlia representa además un activo estratégico en enfermedades raras, un segmento donde la especialización y el pricing premium ayudan a compensar la menor cantidad de pacientes.
Journavx (Vertex): primer analgésico de nueva clase en más de 20 años y alternativa no opioide
En el terreno del dolor agudo, la aprobación de Journavx (suzetrigine) de Vertex Pharmaceuticals marcó un punto de inflexión. La FDA la definió como “la primera nueva clase de medicación para dolor agudo aprobada en más de 20 años” y como un “inhibidor de señales de dolor no opioide” dirigido selectivamente a los canales NaV1.8, evitando el mecanismo central de los opioides.
“Con la aprobación de Journavx… tenemos la oportunidad de cambiar el paradigma del manejo del dolor agudo y establecer un nuevo estándar de cuidado”, afirmó Reshma Kewalramani, CEO de Vertex. Estudios pivotal mostraron que, en adultos con dolor moderado a severo tras procedimientos quirúrgicos, el fármaco logró reducciones de al menos 50% del dolor en proporciones comparables a la combinación hidrocodona/paracetamol, sin evidencia de potencial adictivo ni el “high” típico de los opioides.
Para hospitales y clínicas que buscan reducir la dependencia de opioides en un contexto de crisis de adicción, Journavx abre una nueva clase terapéutica diferenciada, con un claro atractivo para pagadores y reguladores interesados en estrategias de analgesia más seguras.
Blujepa (GSK): primer antibiótico oral de nueva clase para ITU en casi 30 años
En antiinfecciosos, Blujepa (gepotidacina) de GSK fue otro de los aprobados emblemáticos. Se trata de un antibiótico oral “first‑in‑class” que inhibe DNA girasa y topoisomerasa IV bacterianas, y que “se ha convertido en el primer antibiótico oral de una nueva clase aprobado para infecciones urinarias en casi 30 años”, según evaluaciones académicas y regulatorias.
La aprobación de Blujepa para infecciones urinarias no complicadas llega en un momento de preocupación mundial por la resistencia antimicrobiana y ofrece a la atención primaria una herramienta adicional frente a patógenos cada vez menos sensibles a quinolonas y beta‑lactámicos clásicos. Más allá del impacto clínico directo, el producto refuerza la narrativa de que aún es posible desarrollar antibióticos novedosos y rentables, un tema crucial para reactivar la inversión en un área históricamente rezagada en términos de retorno.
Un nuevo contrato de innovación: impacto clínico por encima de la cantidad de aprobaciones
Aunque el conteo bruto de aprobaciones de 2025 fue menor al de años previos, el mix de modalidades y el carácter “first‑in‑class” de productos como Qfitlia, Journavx y Blujepa refuerza la idea de que la industria está girando hacia un modelo donde Impacto > Cantidad y especialización > generalidad. Como sintetiza el análisis de aprobaciones del año, “no se trata de cuántos fármacos aprobamos, sino de cuántos cambian vidas”, una lógica que reconfigura prioridades de I+D, estrategias de portafolio y la competencia entre big pharma y biotechs en campos como ARN terapéutico, analgesia no opioide y antimicrobianos de nueva generación.







Leave A Comment