IA en el quirófano: cirugías fallidas, partes del cuerpo mal identificadas y reguladores escasos
- curecompass
- 14 febrero, 2026
- Salud, Tecnología
- Acclarent, Diagnostics and Software Reliability, Division of Imaging, FDA, Inteligencia Artificial, Jeff Hopkins, Johns Hopkins Lyme Disease Clinical Research Center, Johnson & Johnson, Portada, Samsung Medison, Sonio Detect, TruDI Navigation System
- 0 Comments
En el mundo de la IA no todas las noticias son positivas. Desde que Acclarent, entonces unidad de Johnson & Johnson, sumó IA a su sistema de navegación TruDi para cirugías de sinusitis, los reportes a la FDA pasaron de 8 a más de 100 y al menos 10 pacientes resultaron lesionados, mientras proliferan reclamos por fallos en monitores cardíacos y ecografías fetales.
Nadie en el mundo puede negar los enormes avances que realizó la medicina con la aplicación de la Inteligencia Artificial en diferentes funciones relacionadas a la salud. Claro, eso no significa que durante su introducción en la vida cotidiana de los profesionales de la salud y de los pacientes que deben ser intervenidos con la nueva tecnología, no haya problemas en su aplicación.
En algunos casos, el uso de la IA ya lleva más de una década, en muchos casos dejó de ser una promesa de laboratorio para convertirse en pieza central de la nueva generación de dispositivos médicos: sistemas de navegación quirúrgica, monitores cardíacos implantables, plataformas de imagenología y, cada vez más, aplicaciones de salud de consumo como el diseño de nuevos y más eficientes fármacos.
Sus defensores aseguran que la tecnología “revolucionará” la medicina, desde la detección precoz de tumores hasta la planificación de cirugías complejas. Pero a medida que la IA entra al quirófano y a la sala de guardia, también se acumulan reportes de cirugías fallidas, diagnósticos erróneos y órganos mal identificados.
A su vez, posiblemente lo más preocupante, ante semejante velocidad de las experiencias positivas, los reguladores admiten que les cuesta seguir el ritmo del boom de productos habilitados con algoritmos.
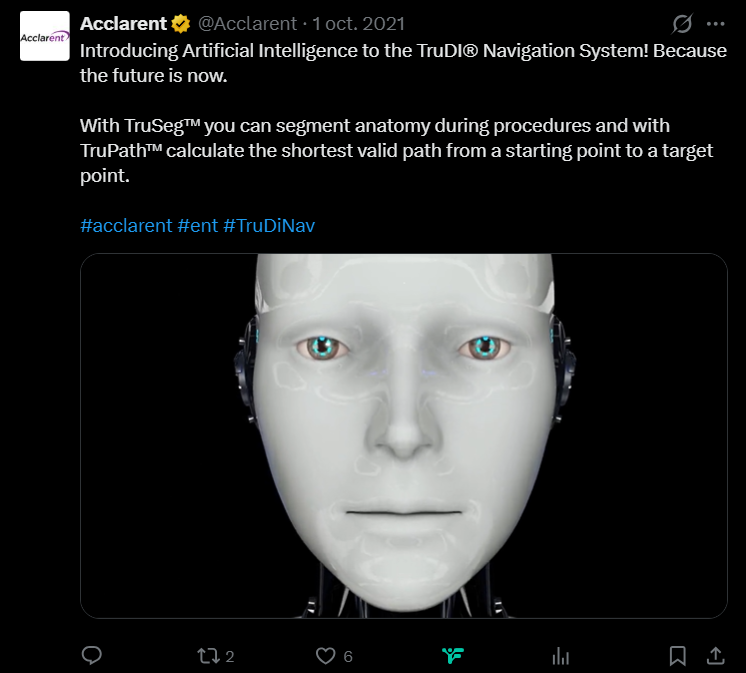
Un caso emblemático es el del TruDi Navigation System, desarrollado por Acclarent, que en 2021 —cuando aún era una unidad de Johnson & Johnson— anunció “a leap forward”: había integrado un algoritmo de “machine learning” para asistir a otorrinolaringólogos en cirugías de sinusitis crónica. El dispositivo llevaba unos tres años en el mercado; hasta entonces, la FDA había recibido reportes no confirmados de siete malfuncionamientos y una lesión en paciente. Desde la incorporación de IA, el organismo recibió al menos 100 reportes de fallas y eventos adversos, incluidos al menos 10 pacientes lesionados entre finales de 2021 y noviembre de 2025.
TruDi: más reportes tras la IA, dos ACV y demandas en Texas
La mayoría de los incidentes reportados con TruDi involucran errores en la localización de los instrumentos dentro de la cabeza del paciente durante la cirugía: el sistema habría entregado información equivocada sobre dónde se encontraban las herramientas. Entre los casos documentados figuran una fuga de líquido cefalorraquídeo por la nariz, la perforación accidental de la base del cráneo y dos pacientes que “supuestamente sufrieron accidentes cerebrovasculares después de que se lesionara de forma accidental una gran arteria”.
Las víctimas de esos dos ACV presentaron demandas en Texas alegando que la IA del sistema TruDi contribuyó a sus lesiones. Una de las demandas sostiene que “el producto era posiblemente más seguro antes de integrar cambios en el software para incorporar inteligencia artificial que después de que se implementaran esas modificaciones”. Reuters no pudo verificar de forma independiente estas acusaciones.
Consultada por los reportes, Johnson & Johnson remitió las preguntas a Integra LifeSciences, que adquirió Acclarent y TruDi en 2024. Integra declaró que los informes “no hacen nada más que indicar que un sistema TruDi estaba en uso en una cirugía donde se produjo un evento adverso” y añadió que “no hay evidencia creíble que muestre una conexión causal entre el TruDi Navigation System, la tecnología de IA y ninguna de las supuestas lesiones”.
De “herramienta de marketing” a cuestionamientos por seguridad
Las demandas también arrojan luz sobre cómo se tomó la decisión de añadir IA al sistema. En una de ellas se afirma que el entonces presidente de Acclarent, Jeff Hopkins, impulsó la integración de IA en TruDi “como herramienta de marketing” para poder afirmar que el dispositivo “tenía tecnología nueva y novedosa”. Según la querella, el software de TruDi usa machine learning para identificar segmentos anatómicos específicos y calcular “el camino válido más corto entre dos puntos especificados por el médico”, con el objetivo de simplificar la planificación quirúrgica y ofrecer feedback en tiempo real.
La misma demanda sostiene que el cirujano Marc Dean, consultor de Acclarent desde 2014, advirtió a la compañía “que había problemas que debían resolverse” antes de integrar la IA, pero que, pese a la alerta, la empresa “bajó sus estándares de seguridad para apresurar la nueva tecnología al mercado” y llegó a fijar “como objetivo solo un 80% de precisión para parte de esta nueva tecnología antes de integrarla en el TruDi Navigation System”. Integra y Acclarent han negado las acusaciones y, en documentos judiciales, dijeron que Acclarent solo distribuía el sistema y no lo diseñaba ni fabricaba.
Dean recibió más de U$S 550.000 en honorarios de consultoría de Acclarent entre 2014 y 2024, de los cuales al menos U$S 135.000 estuvieron ligados al sistema TruDi, según el registro federal Open Payments. Un abogado del médico dijo que no podía hacer comentarios por la confidencialidad de los pacientes y los litigios en curso. Integra afirmó que Dean ya no es consultor de TruDi y que los pagos tras la adquisición se limitaron a comidas.
Más de 1.357 dispositivos con IA autorizados y 182 retiros vinculados
El caso TruDi es solo la punta del iceberg de un ecosistema que crece a gran velocidad. Al menos 1.357 dispositivos médicos que usan IA están autorizados por la FDA, el doble de los que estaban aprobados hasta 2022. De los reportes enviados a la agencia entre 2021 y octubre de 2025, al menos 1.401 se referían a dispositivos incluidos en esa lista, y 115 mencionaban problemas con el software, los algoritmos o la programación.
Un análisis de investigadores de Johns Hopkins, Georgetown y Yale, publicado en JAMA Health Forum en agosto, identificó 60 dispositivos con IA autorizados por la FDA asociados a 182 retiros de productos. El 43% de esos retiros ocurrió en menos de un año desde la autorización, “aproximadamente el doble de la tasa de retiros de todos los dispositivos autorizados bajo reglas similares”, señalaron los autores. La mayoría de los retiros se debió a errores diagnósticos o de medición, seguidos por demoras funcionales y riesgos físicos o bioquímicos.
Entre los ejemplos recientes figura Sonio Detect, un software de IA para ecografías prenatales de Samsung Medison. Un reporte a la FDA de junio de 2022 advertía que el algoritmo “es defectuoso y etiqueta de forma incorrecta estructuras fetales, asociándolas con partes del cuerpo equivocadas”. Si bien no se informó daño a pacientes y la empresa sostuvo que el informe “no indica ningún problema de seguridad” ni motivó pedidos de acción por parte de la FDA, el caso ilustra la sensibilidad del uso de IA en contextos como la medicina fetal.
Al menos 16 reportes mencionaron monitores cardíacos con IA de Medtronic que no habrían reconocido pausas o arritmias. La compañía aseguró haber revisado los 16 episodios y concluyó que su dispositivo solo omitió una arritmia verdadera, sin que se registraran daños. Medtronic explicó que parte de los incidentes se debieron a problemas de visualización de datos o “confusión del usuario” y recordó que su algoritmo AccuRhythm AI, basado en “deep learning”, redujo de forma sustancial las alarmas falsas manteniendo las verdaderas.
Menos científicos de IA en la FDA y un marco regulatorio pensado para otra era
Cinco científicos actuales y anteriores de la FDA que revisan dispositivos con IA dijeron a Reuters que la agencia hoy está menos preparada para manejar la avalancha de productos con algoritmos. Hace unos cuatro años, el organismo había ampliado su equipo de especialistas en IA, en particular en la Division of Imaging, Diagnostics and Software Reliability (DIDSR), que llegó a contar con unas 40 personas y se convirtió en el principal recurso interno para evaluar seguridad en radiología e imagen médica.
Pero a comienzos del año pasado, la administración Trump comenzó a desmantelar esa unidad como parte de la campaña de recortes del Departamento de Eficiencia Gubernamental (DOGE), impulsada por Elon Musk. Unos 15 de los 40 científicos de IA de DIDSR fueron despedidos o se marcharon, y el Digital Health Center of Excellence, encargado de la política para dispositivos con IA, perdió alrededor de un tercio de su plantilla, que rondaba las 30 personas. “Si no tenés los recursos, es más probable que se te pasen cosas”, advirtió un exrevisor de dispositivos que dejó la agencia el año pasado.
“Algunos reguladores senior no tienen idea de cómo funcionan estas tecnologías”, dijo otro ex empleado, que describió cómo los científicos del área se sentaban con los decisores para explicar por qué consideraban que una IA era o no segura para salir al mercado. El Departamento de Salud y Servicios Humanos, del que depende la FDA, aseguró en cambio que el organismo “aplica los mismos estándares rigurosos a los dispositivos con aprendizaje automático y otras formas de IA que a cualquier otro producto” y que “la seguridad del paciente es la máxima prioridad”, al tiempo que sigue reclutando talento en salud digital y tecnologías emergentes.
A diferencia de los fármacos, que requieren ensayos clínicos, la mayoría de los dispositivos con IA llegan al mercado sin pruebas prospectivas en pacientes. Conforme a las reglas actuales, muchos fabricantes satisfacen los requisitos citando dispositivos previos autorizados sin capacidades de IA, aprovechando el mecanismo 510(k) de equivalencia sustancial. Para el especialista en regulación de dispositivos médicos Alexander Everhart, de la Washington University en St. Louis, esa lógica tiene límites claros frente a algoritmos que aprenden, se actualizan y pueden comportarse de forma no lineal. “Creo que el enfoque tradicional de la FDA para regular dispositivos médicos no está a la altura de la tarea de garantizar que las tecnologías habilitadas con IA sean seguras y efectivas”, afirmó. “Estamos confiando en que los fabricantes hagan bien las cosas al lanzar productos, y no sé si lo que hay en la FDA hoy representa barreras significativas”.
En un escenario donde más de 1.357 dispositivos médicos con IA ya compiten en el mercado estadounidense y las grandes tecnológicas, farmacéuticas y fabricantes de equipamiento buscan diferenciarse con “cirugía aumentada” y diagnósticos automatizados, el equilibrio entre innovación rápida y salvaguardas sólidas marcará tanto la trayectoria del sector de salud digital como el apetito inversor por plataformas de IA clínica de alta complejidad.








Leave A Comment