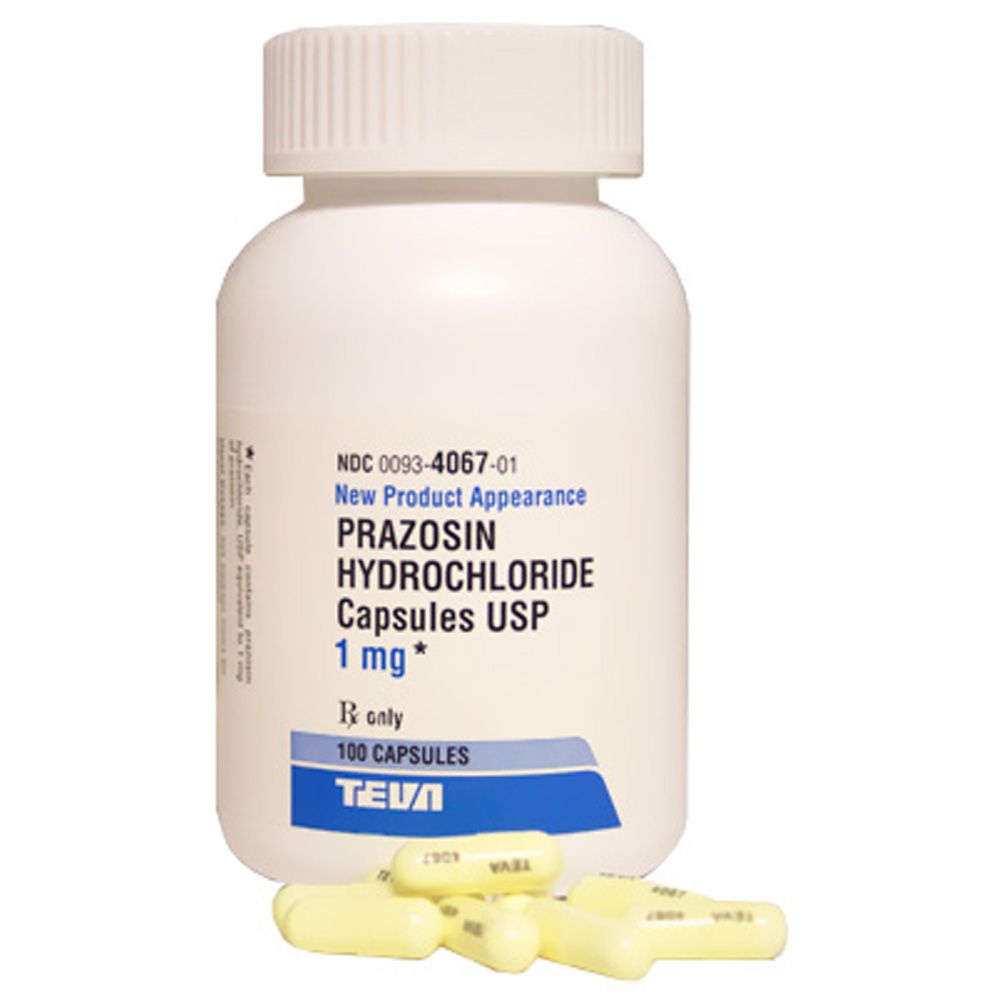
Teva retira un medicamento para la presión por presencia de impurezas potencialmente cancerígenas
- Redacción
- 3 noviembre, 2025
- Importante
- Amerisource Health Services, FDA, Portada, Prazosin Hydrochloride, Teva Pharmaceuticals
- 0 Comments
Teva Pharmaceuticals retiró más de medio millón de frascos de un medicamento para la presión por presencia de impurezas potencialmente cancerígenas. Fueron más de 580.000 frascos del medicamento Prazosin Hydrochloride. Este medicamento se utiliza principalmente para el tratamiento de la presión arterial alta. Y en algunos casos, para aliviar pesadillas asociadas al trastorno de estrés postraumático (TEPT).
La medida la tomó Teva y Amerisource Health Services luego de que se detectaran niveles superiores a los permitidos de una impureza potencialmente cancerígena. El retiro lo confirmó la FDA, que clasificó la acción como un recall de Clase II. Una categoría que indica que el uso del producto podría provocar consecuencias adversas temporales o reversibles para la salud, aunque el riesgo de efectos graves es bajo.
Como indicó el informe de la FDA, las pruebas de control detectaron la presencia de N-nitroso Prazosin impurity C. Una sustancia perteneciente a la familia de las nitrosaminas. Se encontraba en niveles superiores al límite de ingesta aceptable que estableció el organismo bajo el enfoque de categorización de la potencia carcinogénica (CPCA).
Las nitrosaminas son compuestos químicos que se forman de manera natural en el medio ambiente. Y pueden encontrarse en pequeñas cantidades en el agua o los alimentos. Sin embargo, durante los procesos de fabricación o almacenamiento de medicamentos, pueden generarse concentraciones más elevadas que resulten potencialmente carcinogénicas.
“Los resultados de laboratorio indicaron que el nivel de nitrosamina en ciertos lotes de Prazosin Hydrochloride estaba por encima del umbral de seguridad”, detalló la FDA. La agencia subrayó que, aunque la probabilidad de efectos graves es remota, los pacientes deben revisar los números de lote de sus medicamentos para confirmar si están incluidos en el retiro.
El retiro afecta frascos de 1 mg, 2 mg y 5 mg de cápsulas de Prazosin Hydrochloride, en presentaciones que varían entre 20 y 1.000 cápsulas por envase. Las partidas se distribuyeron a nivel nacional por Teva y Amerisource.
El proceso de retiro comenzó el 7 de octubre, según los informes de la FDA, y se clasificó oficialmente como Clase II el 25 de octubre. En total, se calcula que 588.042 frascos seincluyeron en la medida preventiva. Hasta el momento, ni Teva ni Amerisource emitieron comunicados públicos sobre el retiro. Ambas empresas se limitaron a notificar al organismo regulador y a los canales de distribución para iniciar la recuperación de los lotes comprometidos.
La FDA y especialistas en salud recomiendan no suspender el medicamento sin consultar previamente con un médico o farmacéutico. Detener abruptamente el tratamiento para la presión arterial puede generar riesgos importantes para la salud. “Es fundamental que los pacientes no dejen de tomar sus medicamentos sin orientación médica”, advirtieron desde la agencia. “Quienes tengan frascos del producto deben verificar el número de lote y, si está afectado, comunicarse con su proveedor de salud para analizar las alternativas disponibles”.
El Prazosin Hydrochloride actúa relajando los vasos sanguíneos, lo que permite que la sangre circule con mayor facilidad y reduce la presión arterial. Además de su uso principal para la hipertensión, el fármaco se prescribe en algunos casos para pacientes con TEPT, con el fin de disminuir la frecuencia e intensidad de las pesadillas.
En los últimos años, la presencia de impurezas de nitrosamina llevó a varias farmacéuticas a retirar distintos medicamentos del mercado. Casos similares se registraron con antihipertensivos como la valsartán y la losartán. Lo que llevó a las autoridades sanitarias a reforzar los controles de calidad en la producción y almacenamiento.
La FDA continúa evaluando las causas del incremento en los niveles de nitrosaminas y trabaja junto a las compañías farmacéuticas para mejorar los procesos de fabricación. “Nuestro objetivo es garantizar que todos los medicamentos disponibles en el mercado sean seguros y cumplan con los estándares regulatorios”, afirmó el organismo.
Mientras tanto, los consumidores pueden consultar la lista de productos afectados en el sitio oficial de la FDA. Donde se detalla cada lote involucrado y las instrucciones para el retorno o reemplazo de los frascos.











Leave A Comment