
Rinosinusitis crónica con pólipos: se amplía el uso de Tezspire de Amgen y AstraZeneca
- curecompass
- 18 octubre, 2025
- I+D, Medicina
- Amgen, AstraZeneca, FDA, Portada, Regeneron, Rinosinusitis, Sanofi, Tezspire
- 0 Comments
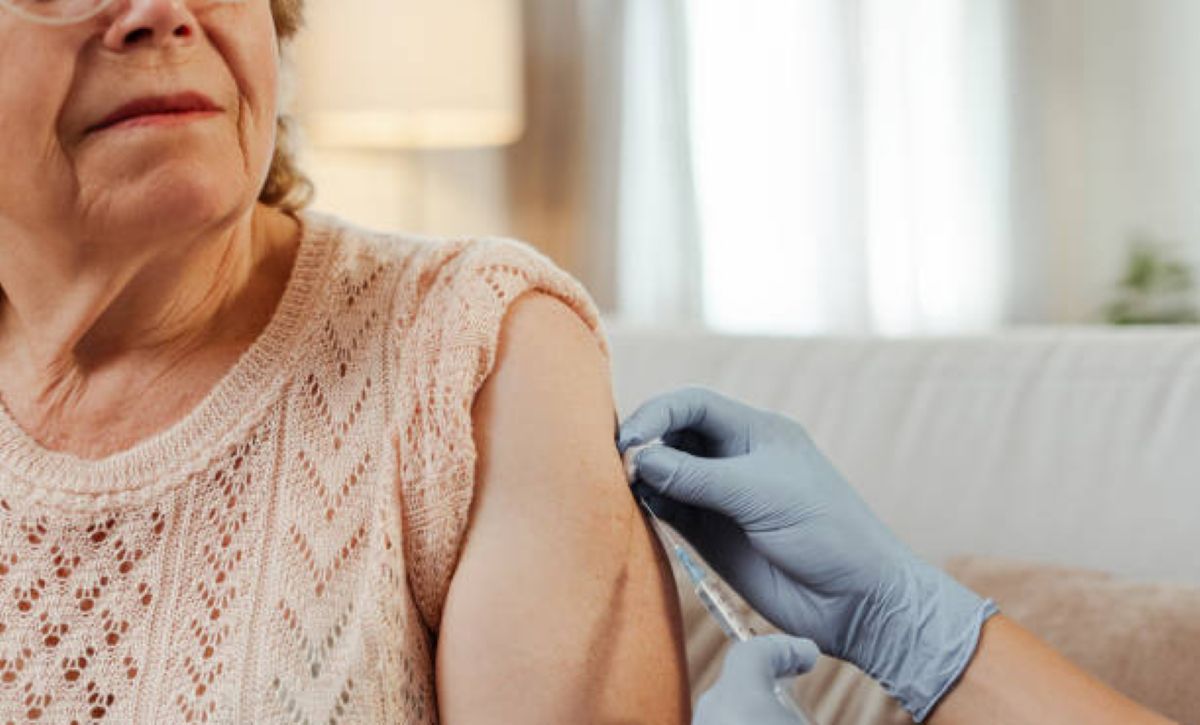
El medicamento biológico Tezspire logra reducir en un 98% las cirugías por pólipos nasales y en un 88% la necesidad de esteroides orales, según datos clínicos.
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó una nueva indicación para Tezspire (tezepelumab-ekko), desarrollado por Amgen y AstraZeneca, que amplía su uso como tratamiento de mantenimiento complementario en pacientes adultos y pediátricos (de 12 años o más) con rinosinusitis crónica con pólipos nasales (CRSwNP) mal controlada.
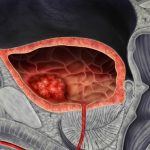
Esta patología se caracteriza por una inflamación persistente de los senos paranasales durante 12 semanas o más, que causa el crecimiento de masas benignas denominadas pólipos nasales. Los síntomas incluyen dolor facial, congestión y disminución del sentido del olfato, afectando la calidad de vida de los pacientes y, en muchos casos, requiriendo intervenciones quirúrgicas repetidas.
Tezspire, que ya contaba con aprobación en Estados Unidos, la Unión Europea y otros mercados como tratamiento complementario para el asma grave, mostró resultados sólidos en un ensayo clínico de fase avanzada. El medicamento logró una reducción clínicamente significativa en el tamaño de los pólipos nasales y en la congestión frente al placebo. Además, disminuyó en un 98% la cantidad de pacientes que necesitaron cirugía y redujo en un 88% el uso de corticoides orales, según datos presentados por las farmacéuticas.
Antes de la aprobación, el analista Matt Phipps, de William Blair, señaló que los resultados de Tezspire podrían demostrar una mayor eficacia que Dupixent, de Sanofi y Regeneron, para este tipo de pacientes. Otros tratamientos aprobados para la rinosinusitis crónica incluyen también Nucala, de GSK, y Xolair, desarrollado por Roche y Novartis.
Tezspire es un anticuerpo monoclonal que actúa bloqueando la proteína TSLP (linfopoyetina estromal tímica), una vía clave en el inicio y mantenimiento de la inflamación asociada al asma grave y a otras enfermedades inflamatorias de las vías respiratorias.
“La aprobación demuestra la versatilidad de la inhibición de TSLP más allá del asma y resalta el compromiso de ambas compañías por llevar un hallazgo científico relevante a una aplicación más amplia que realmente marque una diferencia para los pacientes”, destacó Kate Chevlen, directora global del portafolio de inflamación de Amgen.
Con este paso regulatorio, Amgen y AstraZeneca consolidan la posición de Tezspire como una opción terapéutica líder en el abordaje de enfermedades inflamatorias respiratorias crónicas, aportando una nueva alternativa para quienes no logran controlar sus síntomas con los tratamientos convencionales.







Leave A Comment