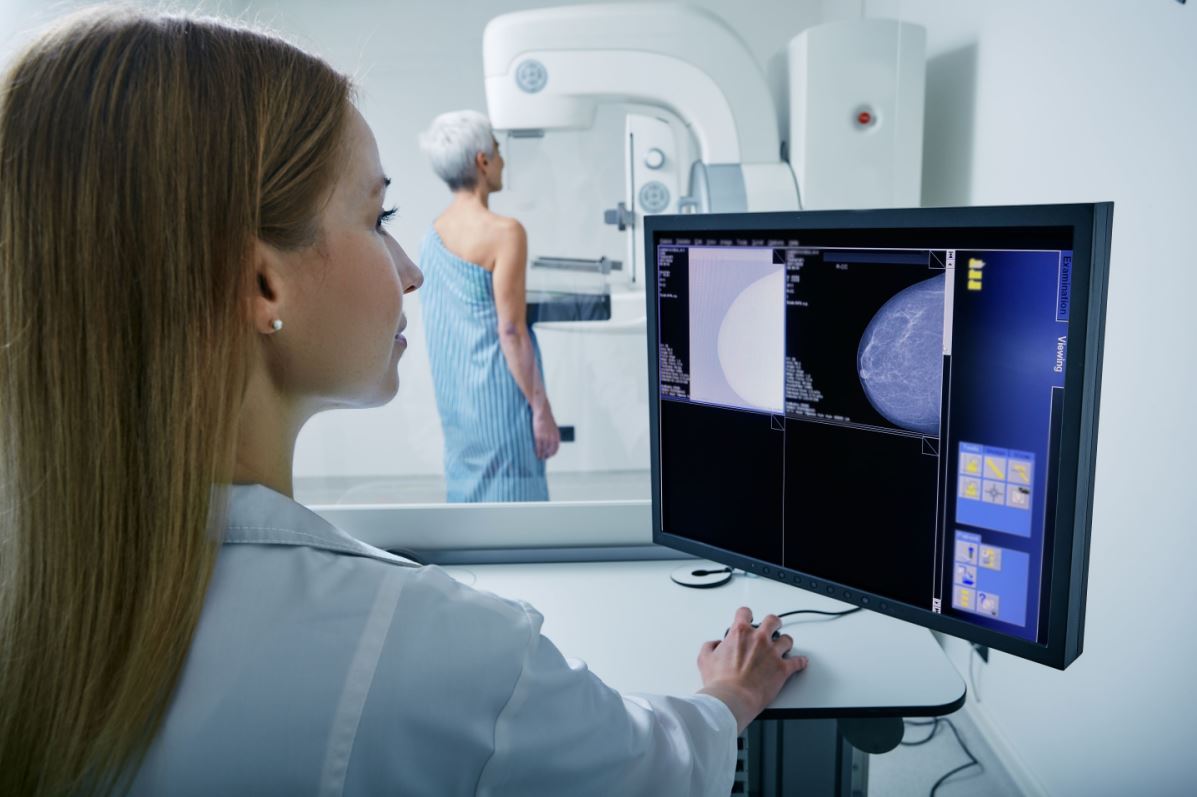
Inluriyo de Eli Lilly aprobado por la FDA para tratamiento de cáncer de mama
- Redacción
- 2 octubre, 2025
- Importante
- Eli Lilly, FDA, imlunestrant, Inluriyo, Portada
- 0 Comments
Eli Lilly anunció que la FDA aprobó Inluriyo (imlunestrant), un antagonista oral del receptor de estrógeno, para el tratamiento de adultos con cáncer de mama avanzado o metastásico (CMM). En el ensayo de fase 3 Ember-3, Inluriyo redujo el riesgo de progresión o muerte en un 38% frente a la terapia endocrina.
Entre los pacientes con CMM con mutación en ESR1, Inluriyo mejoró significativamente la supervivencia libre de progresión (SLP) frente a fulvestrant o exemestano. Con una mediana de SLP de 5,5 meses frente a 3,8 meses.
Inluriyo es un tratamiento para el cáncer de mama metastásico (CMM) con mutaciones en ER+, HER2– y ESR1. Algunos cánceres de mama desarrollan mutaciones en ESR1 que pueden provocar una hiperactividad de los receptores de estrógeno e impulsar el crecimiento del cáncer. Inluriyo se une, bloquea y facilita la degradación de estos receptores, lo que ayuda a ralentizar la progresión de la enfermedad. Su administración una vez al día ofrece a las pacientes una opción de tratamiento oral.
“Esta terapia refleja nuestro compromiso con el desarrollo de tratamientos que mejoren los resultados para las personas con cáncer de mama. Y representa un paso importante hacia el avance de enfoques terapéuticos innovadores y totalmente orales”. Así lo afirmó Jacob Van Naarden, vicepresidente ejecutivo y presidente de Lilly Oncology. “Estamos profundamente agradecidos a las pacientes, los investigadores, los miembros del equipo de Lilly y los equipos de atención clínica que hicieron posible este avance. Esta terapia tiene el potencial de hacer que el tratamiento sea más llevadero para las personas que viven con cáncer de mama”.
La etiqueta de Inluriyo contiene una advertencia y precaución sobre la toxicidad embriofetal. La aprobación de la FDA se basa en los resultados del ensayo Ember-3 en pacientes con CMM con mutación ESR1. Los pacientes recibieron Inluriyo o TE como tratamiento de primera línea para el CMM tras la recurrencia con inhibidor de la aromatasa (IA) adyuvante, con o sin inhibidor de CDK4/6 previo (21%). O como tratamiento de segunda línea para el CMM tras la progresión con IA, con o sin inhibidor de CDK4/6 previo (79%).
“Esto representa un avance importante para los pacientes con CMM con mutación ESR1. Una mutación presente en casi la mitad de los pacientes que recibieron terapias hormonales. Lo que a menudo contribuye a la resistencia al tratamiento”. Así lo afirmó Komal Jhaveri, jefe de sección de Investigación en Terapia Endocrina y director clínico de Desarrollo Temprano de Fármacos en el Memorial Sloan Kettering Cancer Center. Asimismo fue el investigador principal del Ember-3. “Con su eficacia demostrada, perfil de tolerabilidad y administración oral, esta terapia ofrece una alternativa terapéutica significativa para esta población de pacientes”.
En el estudio Ember-3, la mayoría de los eventos adversos (EA) con Inluriyo fueron de bajo grado (Grado 1-2). Y las reacciones adversas más comunes (≥10%), incluyendo anomalías de laboratorio, fueron disminución de la hemoglobina, dolor musculoesquelético, disminución del calcio, disminución de los neutrófilos, aumento de la AST, fatiga, diarrea, aumento de la ALT, aumento de los triglicéridos, náuseas, disminución de las plaquetas, estreñimiento, aumento del colesterol y dolor abdominal.
En el estudio, el 4,6% de las pacientes interrumpió permanentemente el tratamiento debido a EA. Se produjeron reducciones e interrupciones de la dosis en el 2,4% y el 10% de las pacientes, respectivamente.
“La aprobación de Inluriyo amplía el panorama del tratamiento del cáncer de mama metastásico para las pacientes con resultado positivo en la mutación ESR1”. Así lo afirmó Jean Sachs, directora ejecutiva de Living Beyond Breast Cancer. “Las pacientes elegibles ahora tendrán acceso a una opción de tratamiento adicional. Lo que les ofrece la posibilidad de flexibilidad en su vida diaria y en el manejo de la enfermedad, y, sobre todo, una renovada esperanza para el futuro”.
Inluriyo también se está estudiando en el ensayo de fase 3 Ember-4, actualmente en curso. Como tratamiento adyuvante para personas con cáncer de mama temprano (CMP) ER+ y HER2– con mayor riesgo de recurrencia. En el que se están inscribiendo aproximadamente 8.000 pacientes en todo el mundo. Se espera que Inluriyo esté disponible en Estados Unidos en las próximas semanas.











Leave A Comment